O governador Rui Costa criticou no programa Balanço Geral, da TV Record Itapoan, nesta sexta-feira (19), a postura da Agência Nacional de Vigilância Sanitária (Anvisa) sobre a demora em liberar as vacinas da Pfizer, da Sputinik e da Covax Facility para ajudar os países em desenvolvimento a ter acesso a vacinas contra a Covid-19.
"A Anvisa presta um desserviço com a sua desorganização quanto a autorização destes imunizantes que ajudariam a potencializar a vacinação da população contra a Covid-19. Enquanto isso, o povo vai ficando doente, lotando os leitos dos hospitais de campanha e dos hospitais particulares. Estamos com 78% de ocupação dos leitos de UTI adulto e 67% de ocupação dos leitos de UTI pediátrica. Isto é preocupante", disse o governador, que conclama a população a colaborar no combate ao coronavírus.
"Não adianta toque de recolher ou até mesmo lockdown se o povo não ajuda, se não usa a máscara de maneira correta, perambula pelas ruas sem respeitar os protocolos de distanciamento social, lotam as praias, bares e outros estabelecimentos. Se conscientizem".
Atualmente, a Anvisa só liberou as vacinas CoronaVac, produzida pelo laboratório chinês Sinovac em parceria com o Instituto Butantan, e a vacina da Universidade de Oxford/AstraZeneca, produzida no Brasil pela Fiocruz para serem utilizadas como imunizantes.
Em nota enviada a reportagem do Leiamaisba.com.br a Anvisa esclareceu quais são as vacinas que estão com pedido formal de autorização no Brasil. A agência reguladora no entanto, não respondeu sobre as críticas do governador Rui Costa sobre o trabalho desempenhado pela própria agência.
"Não há qualquer outra vacina com pedido formal de qualquer natureza para análise da Anvisa até o presente momento, além das descritas abaixo. Todas as informações sobre andamento de análise de vacinas são públicas e estão disponíveis no site da Anvisa.
As vacinas Coronavac está
A vacina de Oxford está autorizada no Brasil para uso emergencial desde o dia 17 de janeiro de 2021. A vacina de Oxford solicitou o registro definitiv
A vacina da Pfizer solicitou o registro definitivo à Anvisa no dia 6 de fevereiro. Este pedido também está em análise e dentro do prazo estimado.
Covax Facility não é uma vacina. O Covax é um consórcio coordenado pela OMS para acesso às vacinas. As vacinas do Covax Facility já estão autorizadas no Brasil tão logo a OMS faça o reconhecimento das vacinas em análise.
A vacina Sputnik (União Química) solicitou Autorização de Uso Emergencial, mas esse pedido foi devolvido para a empresa solicitante em 16/1/21, devido à ausência de dados e informações previstos no Guia 42/2020. Não há pedido da Sputnik pendente de avaliação pela Agência.
A empresa pode fazer nova submissão os documentos necessários, mas também pode atualizar o mesmo processo e submeter novamente para a Anvisa. Cabe a União Química decidir se fará o estudo clínico no Brasil ou se vai trazer dados de fora do país.
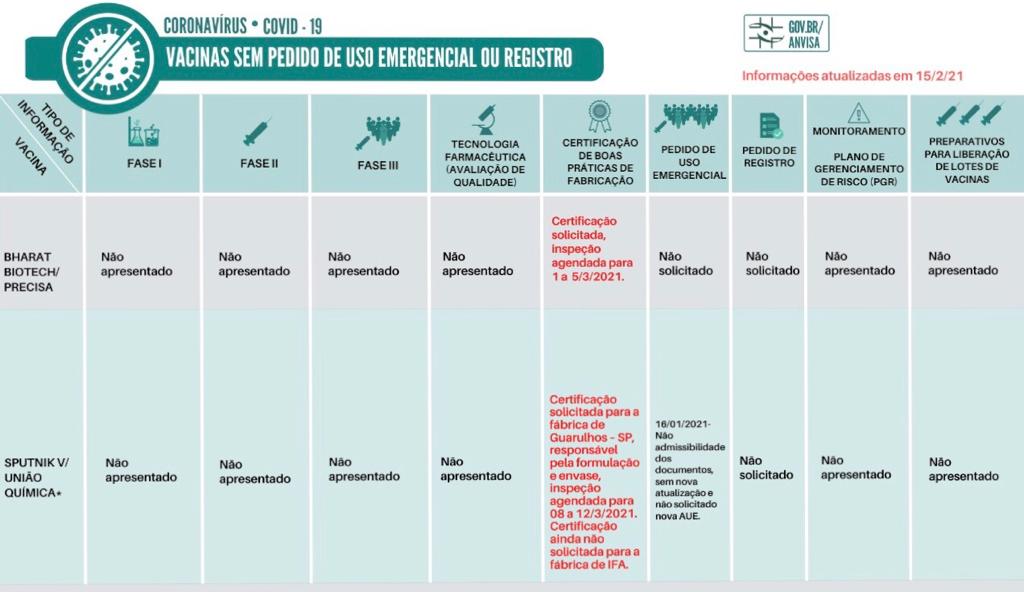
Sobre a vacina Covaxin, até o momento não há pedido de registro, uso emergencial ou autorização de pesquisa da vacina Covaxin, da Bharat, para o Brasil. Assim não há qualquer decisão pendete da Anvisa sobre esta vacina."
Quadro a análises de vacina pela Anvisa
Em seu site, a agência reguladora publicou o andamento e a atualização dos imunizantes :
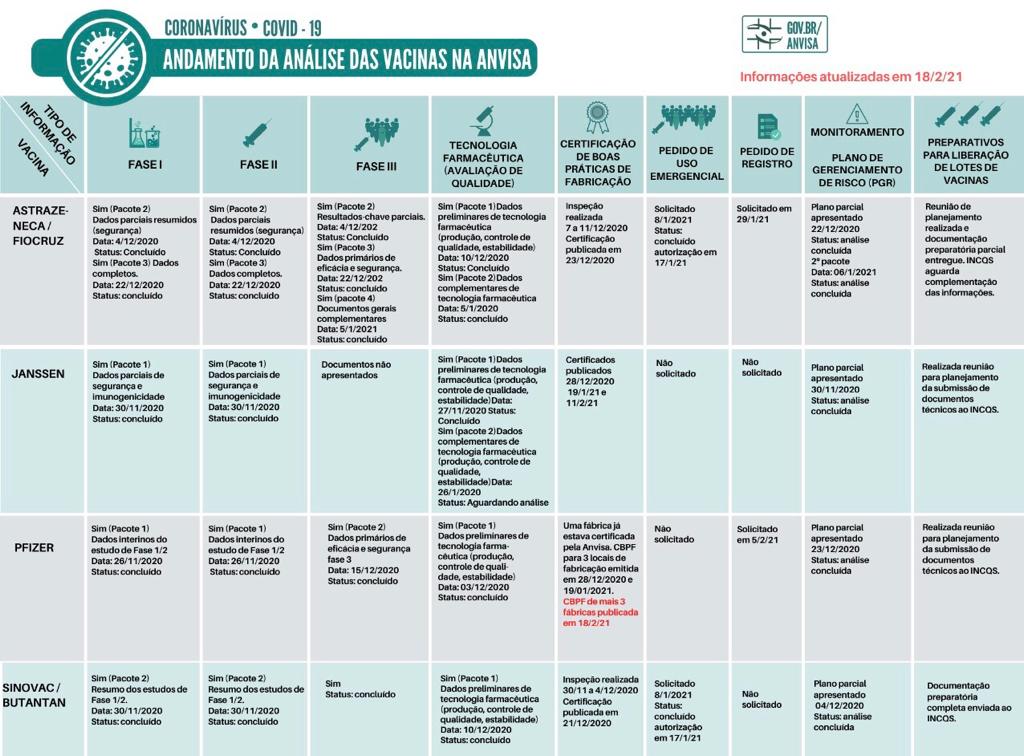
*As informações em vermelho no quadro representam as atualizações mais recentes.
As vacinas Sputnik V e Covaxin/Bharat/Biotech foram incluídas em outra categoria de análise, pois solicitaram, até agora, apenas as Boas Práticas de Fabricação.
Sobre a Sputnik - A Sputnik solicitou AUE (autorização de uso emergencial), mas esse pedido foi devolvido para a empresa solicitante em 16/1/21, devido à necessidade de complementação de dados e informações previstos no Guia 42/2020. a empresa pode fazer nova submissão com todos os documentos, mas também pode atualizar o mesmo processo e submeter novamente para a Anvisa. Importante, esclarecer que não há pedido pendente da avaliação da Agência.
Todas as considerações feitas pela equipe técnica da Anvisa serão disponibilizadas para auxiliar a empresa na instrução do processo de anuência a ser submetido à Agência.
Sobre a Covaxin - A empresa responsável pela vacina Covaxin no Brasil reafirmou que considera importante e que deseja realizar o estudo clínico de fase 3 no país.
A equipe técnica da Anvisa tem disponibilizado todas as informações necessárias ara auxiliar a empresa na instrução do processo de anuência a ser submetido à Agência.
Como funciona cada uma das fases
Fase 1 - essa é a primeira etapa de testes em humanos para avaliar a segurança e possíveis reações indesejáveis no local da aplicação da vacina ou no organismo. Nessa fase também pode ser verificada, de forma preliminar, a imunogenicidade da vacina, ou seja, sua capacidade de gerar anticorpos contra o novo coronavírus.
Fase 2 - é hora de avaliar a dose, a forma de vacinação e a capacidade de gerar anticorpos (contra o novo coronavírus) na população (faixa etária, por exemplo) que deverá ser indicada para receber a vacina. A segurança continua em análise aqui.
Fase 3 - os testes nessa etapa são realizados em grandes populações para avaliar a segurança e a eficácia da vacina. A vacina precisa provar que, de fato, é capaz de nos proteger da doença.
Pedido de uso emergencial - feito antes do registro final para aplicar a vacina em um grupo específico da população. Precisa ser enviado à Anvisa pela empresa fabricante ou importadora da vacina, presente no território brasileiro. Pode ser realizado com a fase 3 em andamento.
Registro - profissionais especializados da Agência vão revisar todos os documentos técnicos e regulatórios e verificar os dados de segurança e eficácia, bem como avaliar a qualidade da vacina. O registro concedido pela Anvisa é o sinal verde para que a vacina seja comercializada e disponibilizada no país. Precisa ser solicitado à Anvisa pela empresa fabricante da vacina.
Dados de eficácia e segurança: essas informações compreendem estudos clínicos e não clínicos. Estão incluídos aqui dados referentes aos estudos realizados em animais e humanos.
Dados de tecnologia farmacêutica: são dados referentes à qualidade, ao processo de fabricação e ao controle de qualidade. Eles têm como objetivo demonstrar que o produto será fabricado com qualidade e de forma consistente, dentro das especificações de uso. Esses dados também determinam o prazo de validade do produto.
Pacotes: são grupos de documentos apresentados pelas empresas à Anvisa.
Pacotes 1, 2, 3 e sucessivamente: são pacotes com dados e informações parciais. As empresas apresentarão mais dados e informações em pacotes subsequentes ou quando apresentarem o pedido de registro da respectiva vacina.
Status: é referente à análise de um determinado pacote de documentos.
Submissão parcial: assim chamada porque a empresa não apresentou a documentação completa para o registro da respectiva vacina.
Certificação de Boas Práticas de Fabricação: avaliação realizada por inspetores qualificados para garantir que uma fábrica, em qualquer lugar do mundo, cumpre com os requisitos determinados pela legislação brasileira. São avaliadas as estruturas físicas das áreas de produção, armazenamento e laboratórios de controle de qualidade, além de toda a documentação do sistema de garantia de qualidade da empresa.
Governo distribuirá 4,7 milhões de doses da vacina até março
De acorodcom a Agência Brasil, o ministro da Saúde, Eduardo Pazuello, garantiu, hoje (19), a uma comissão da Frente Nacional de Prefeitos (FNP), que o governo distribuirá mais de 4,7 milhões de doses da vacina contra a covid-19 até o começo de março.

Ao conversar, por videochamada, com o presidente da entidade, o ex-prefeito de Campinas, Jonas Donizette, e outros nove prefeitos, o ministro afirmou que, a partir do próximo dia 24, o ministério começará a distribuir às secretarias estaduais de saúde cerca de 2,7 milhões de doses da vacina CoronaVac, produzidas no Brasil pelo Instituto Butantan, e outros dois milhões de doses da AstraZeneca que o governo está importando da Índia.
Segundo o ministro, todo o novo lote será usado para vacinar apenas pessoas dos grupos prioritários que ainda não receberam a primeira dose do imunizante.
A medida visa acelerar o processo de vacinação no país. “Neste novo momento da campanha, a vacina do Butantan será aplicada em dose única, com o objetivo de ampliar a vacinação e atender ainda mais brasileiros. Com isso, entramos em março com a expectativa de vacinar novos grupos”, disse o ministro à comissão da FNP.
A segunda dose da vacina do Butantan será aplicada de 14 a 28 dias após a primeira, conforme orientação do fabricante e dependerá dos novos lotes que devem chegar ao país até março.
Logo após o término da conversa, o presidente da frente disse a jornalistas que o ministro sugeriu aos prefeitos que receberem ofertas para adquirir eles próprios suas vacinas, que encaminhem os representantes dos laboratórios farmacêuticos ao ministério.
“Há um problema acontecendo. Muitas cidades e estados [estão] dizendo: “Ah! A gente compra por aqui”. O ministro foi muito enfático: quem tem vacina para vender pode mandá-las para o ministério que a pasta compra”, comentou Donizette, acrescentando que compete ao governo federal centralizar a aquisição de vacinas.
“Há municípios que, às vezes, querem fazer a compra, mas nós temos o Programa Nacional de Imunização. Logo, se existe disponibilidade de vacina à venda, todas devem ir para o programa nacional, embora eu ache que também pudéssemos contar com a iniciativa privada, que pode comprar e doar os imunizantes para o programa nacional [coordenado pelo ministério]”, acrescentou Donizette.
A expectativa ministerial é receber outras 39 milhões de doses de vacinas ao longo do próximo mês: 21 milhões do Instituto Butantan e 18 milhões da AstraZeneca, sejam das produzidas pela Fiocruz, sejam importadas.
Cronograma de Entrega de Vacinas para todo o Brasil
Na quarta-feira (17), o Ministério da Saúde apresentou o cronograma de entrega de 230 milhões de doses de vacinas para serem entregues até julho.
As próximas entregas aos estados acontecem ainda em fevereiro: serão 2 milhões de doses da AstraZeneca/Fiocruz, importadas da Índia, e 9,3 milhões da Sinovac/Butantan, produzidas no Brasil.
Em março, a pasta também aguarda a chegada de 18 milhões de doses da vacina do Butantan e mais 16,9 milhões da vacina da AstraZeneca.
O cronograma do primeiro semestre apresentado pelo ministro também leva em conta as negociações com os laboratórios União Química/Gamaleya e Precisa/Bharat Biotech, que garantirão ao Brasil a chegada da vacina russa Sputnik V e da indiana Covaxin, respectivamente. A previsão é de que o contrato com os dois laboratórios seja assinado ainda nesta semana.
Confira, abaixo, o cronograma de entregas e quantidades previstas em contratos:
Fundação Oswaldo Cruz (vacina AstraZeneca/Oxford)
Janeiro: 2 milhões (entregues)
Fevereiro: 2 milhões (importadas da Índia)
Março: 4 milhões (importadas da Índia) + 12.900.000 -- produção nacional com Insumo Farmacêutico Ativo (IFA) importado
Abril: 4 milhões (importadas da Índia) + 27,3 milhões -- produção nacional com IFA importado
Maio: 28,6 milhões --produção nacional com IFA importado
Junho: 28,6 milhões-- produção nacional com IFA importado
Julho: 3 milhões -- produção nacional com IFA importado
Total primeiro semestre: 112,4 milhões de doses
A partir do segundo semestre, com a incorporação da tecnologia da produção da matéria-prima (IFA), a Fiocruz deverá entregar mais 110 milhões de doses, com produção 100% nacional.
Fundação Butantan (vacina Coronavac/Sinovac)
Janeiro: 8,7 milhões (entregues)
Fevereiro: 9,3 milhões
Março: 18,1 milhões
Abril: 15,9 milhões
Maio: 6 milhões
Junho: 6 milhões
Julho: 13,5 milhões
Total: 77,6 milhões de doses
Até setembro, serão entregues mais de 22,3 milhões de doses da Coronavac, totalizando os 100 milhões contratados pelo Ministério da Saúde.
Covax Facility
Março: 2,6 milhões (vacina importada da AstraZeneca/Oxford)
Até junho: 8 milhões (vacina importada da AstraZeneca/Oxford)
Total: 10,6 milhões de doses
União Química (vacina Sputnik V/Instituto Gamaleya/RUS)
Março: 400 mil (importadas da Rússia)
Abril: 2 milhões (importadas da Rússia)
Maio: 7,6 milhões (importadas da Rússia)
Total: 10 milhões de doses
Com a incorporação da tecnologia da produção do IFA, a União Química deverá produzir, no Brasil, 8 milhões de doses por mês.
Precisa Medicamentos (vacina Covaxin/Barat Biotech/IND)
Março: 8 milhões (importadas da Índia)
Abril: 8 milhões (importadas da Índia)
Maio: 4 milhões (importadas da Índia)
* Matéria atualizada às 17:37 h para adicionar o posicionamwnto da Anvisa